In diesem Artikel erfährst du, wie du auch ohne Labor ein hochwertiges Kolloid von einer einfachen Metallionenlösung oder einem Farbstoff-Fake unterscheiden kannst – mit Laser-Test, Optik, Leitfähigkeit und einer praktischen 5-Punkte-Checkliste.
Wer sich mit kolloidalem Silber, Gold, Platin & Co. beschäftigt, stößt schnell auf eine Vielzahl von Produkten – von „Hochvolt-Kolloid“ über „ionisches Silber“ bis hin zu bunt eingefärbten „Goldwässern“. Für Endkunden ist es ohne Labor oft schwer, echte Nanopartikel-Kolloide von einfachen Ionenlösungen oder reinen Marketingprodukten zu unterscheiden.
Die gute Nachricht: Mit ein paar einfachen Beobachtungen und Hilfsmitteln kannst du dir auch als Laie ein erstaunlich gutes Bild davon machen, wie „sauber“ ein Kolloid wirklich ist – zumindest im physikalisch-kolloidchemischen Sinn.
In diesem Artikel schauen wir uns an:
- Was ein Kolloid aus wissenschaftlicher Sicht ausmacht
- Welche Rolle Optik, Tyndall-Effekt und Stabilität spielen
- Wie du Hochvolt-Kolloide von einfachen Niedervolt-Lösungen unterscheiden kannst
- Warum Leitfähigkeit (EC-Wert), Farbe und Herstellertransparenz zusammen ein gutes Bild ergeben
Was ist ein Kolloid – und was unterscheidet es von einer Lösung?
In der Kolloidchemie versteht man unter einem Kolloid ein System, in dem feinste Partikel (typischerweise etwa 1–1000 nm) in einem anderen Medium (z. B. Wasser) verteilt sind. Die Partikel sind:
- zu groß, um sich wie einzelne Moleküle einer echten Lösung zu verhalten,
- aber zu klein, um schnell auszufallen wie grobe Partikel in einer Suspension.
Bei kolloidalen Metallen (Silber, Gold, Platin, Palladium, Kupfer, etc.) heißt das:
- Die Metalle liegen als Nanopartikel in Wasser vor.
- Diese Partikel bleiben – bei guter Stabilität – lange in Schwebe.
- Unter einem Lichtstrahl zeigen sie einen typischen Effekt: den Tyndall-Effekt.
In einer echten Lösung (z. B. Kochsalz in Wasser) gibt es keine Partikel in diesem Sinn. Die Ionen sind molekular verteilt; das System bleibt optisch völlig gleichmäßig und streut praktisch kein Licht im Strahl.
Der Tyndall-Effekt: der „Laser-Test“ für Zuhause
Der Tyndall-Effekt ist eines der einfachsten und zugleich zuverlässigsten Merkmale, um zwischen echten Kolloiden und klaren Lösungen zu unterscheiden: Ein Lichtstrahl wird an den Kolloidpartikeln gestreut, so dass der Weg des Lichts im Medium sichtbar wird.
So kannst du das zu Hause testen:
- Nimm ein sauberes Glas und fülle etwas von deinem Kolloid hinein.
- Dunkle den Raum leicht ab.
- Leuchte seitlich mit einem Laserpointer (ideal: grüner Laser ~532 nm) durch das Glas.
- Bei einem echten Kolloid siehst du im Glas einen feinen, klaren dünnen Lichtstrahl – den Tyndall-Strahl.
- Bei einer reinen Ionenlösung (z. B. nur Silberionen im Wasser) bleibt der Lichtweg nahezu unsichtbar, ähnlich wie bei reinem Wasser.
Spannend ist noch eine zusätzliche Beobachtung:
Je ruhiger und homogener der Lichtstrahl erscheint, desto gleichmäßiger ist in der Regel die Partikelgrößenverteilung. Wenn der Strahl dagegen stark „glitzert“ und viele unruhig aufflackernde Lichtpunkte zeigt, deutet das darauf hin, dass sehr unterschiedlich große Partikel und Aggregate im Spiel sind – ein Hinweis auf eine weniger saubere Kolloidqualität.

Optik, Farbe und Stabilität im Alltag (kolloidales Silber, Gold +)
Ein hochwertiges Metallkolloid ist in der Regel:
- optisch klar
- zeigt keine groben Trübungen, Schlieren oder Flocken
- bildet bei normaler Lagerung nicht schon nach kurzer Zeit Bodensatz
Leichte Trübungen können bei bestimmten Metallen und höheren Konzentrationen vorkommen, sollten aber nicht in deutliche „Wolken“ oder sichtbare Partikel übergehen.
Farbe – schön, aber nicht alles
Viele Kunden kennen typische Farben:
- Kolloidales Gold: oft minimal rosa/rötlich bis violett (abhängig von Partikelgröße)
- Kolloidales Silber: von farblos bis zart gelblich / leicht bräunlich, je nach Konzentration und Partikelgröße
Wichtig:
Farbe allein ist kein Beweis für ein gutes Kolloid. Man kann Wasser mit Lebensmittelfarbe oder anderen Farbstoffen einfärben, so dass es „goldig“ oder „rosé“ wirkt – ohne dass ein einziges Metallnanopartikel enthalten ist.
Ein Farbstoff-Fake lässt sich meist so entlarven:
- Die Flüssigkeit zeigt keinen oder nur einen sehr schwachen Tyndall-Effekt beim Lasertest.
- Der Hersteller macht keine konkreten Angaben zu ppm, Metallreinheit oder Verfahren, sondern spricht nur von „Goldwasser“, „Energiewasser“ o. Ä.
- Im Zweifelsfall ist der Leitwert extrem niedrig und es gibt keinen Hinweis darauf, dass überhaupt Metall im Spiel ist.
Merksatz:
Eine schöne Farbe kann man billig färben – ein echtes Kolloid erkennt man am Tyndall-Effekt, an der Stabilität und an transparenten technischen Angaben.
Typischer Größenbereich für gut hergestelltes kolloidales Gold
Für klassisches kolloidales Gold (also Gold-Nanopartikel in Wasser), wie man es aus der Kolloidchemie und Biochemie kennt, gibt es einen recht gut etablierten „Sweet Spot“ im Nanometerbereich. Im Groben lässt sich sagen, gut hergestelltes kolloidales Gold liegt typischerweise etwa im Bereich von ca. 5–50 nm Partikeldurchmesser.
Etwas feiner aufgeschlüsselt:
- ca. 3–5 nm
- technisch machbar, aber
- die Farbe wird oft blasser oder geht eher ins Bräunliche,
- die Partikel verhalten sich teilweise anders,
- analytisch interessant, aber im „klassischen Kolloid-Gold-Sinn“ weniger typisch.
ca. 5–30 nm
- sehr schöner Bereich für stabiles, „klassisches“ kolloidales Gold,
- deutlich erkennbarer Tyndall-Effekt,
- typische Rot-/Rubin-Färbung je nach Größe und Konzentration,
- kolloidchemisch gut zu stabilisieren.
ca. 30–50 nm
- immer noch im kolloidalen Bereich,
- die Farbe kann sich Richtung dunkler/deckender verändern,
- die Lichtstreuung nimmt zu, der Tyndall-Strahl wird kräftiger,
- bei höheren Konzentrationen steigt die Gefahr von Aggregation/Ausflockung.
ca. 50–100 nm
- streng genommen oft eher eine Mikropartikel-Suspension als ein feines Kolloid im engeren Sinn,
- Trübung, Bodensatz und Instabilität nehmen zu,
- für hochwertige, feine Hochvolt-Goldkolloide ist das nicht die Zielgröße.
In der Praxis bedeutet das:
Eine Größenangabe im Bereich von etwa 5–30 nm (großzügig 5–50 nm) ist für kolloidales Gold sehr typisch, wenn es gut und kolloidchemisch sauber hergestellt wurde. Das Beispiel zeigt auch, warum nicht nur die ppm-Zahl, sondern vor allem der richtige Größenbereich der Nanopartikel entscheidend für die Qualität eines Kolloids ist.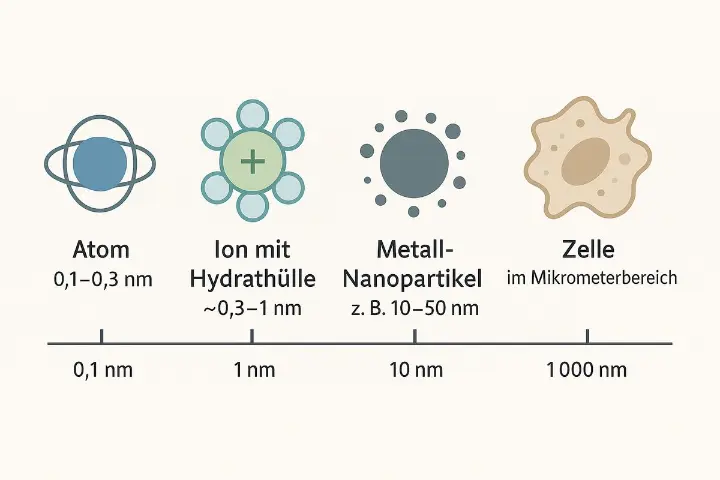
Geschmack – nur als grobe Tendenz
Geschmack ist kein exakter Messparameter, kann aber manchmal Hinweise geben:
- Sehr metallisch, salzig, beißend → deutet eher auf einen hohen Anteil gelöster Ionen/Salze hin (typisch für sehr einfache Elektrolyseprodukte).
- Eher mild, wenig „salzig“ → ist eher kompatibel mit einem höheren Anteil neutraler Nanopartikel.
Wichtig:
Nutze den Geschmackstest als zusätzliche Beobachtung. Für die Qualitätsbeurteilung sind Optik, Tyndall-Effekt, Stabilität und Transparenz des Herstellers deutlich wichtiger.
Hochvolt-Kolloide vs. Niedervolt-Lösungen – was kommt tatsächlich im Glas an?
Vereinfacht gesagt:
- Beim Niedervoltverfahren (klassische Elektrolyse mit moderaten Spannungen) werden vor allem Metallionen aus der Elektrode in das Wasser gelöst. Ein Teil dieser Ionen kann sich zu Nanopartikeln zusammenschließen, der Hauptanteil bleibt jedoch meist ionisch. Man erhält eine ionische Metalllösung mit kolloidalem Anteil.
- Beim Hochvolt-Plasmaverfahren entsteht ein Plasmabogen mit sehr hohen Temperaturen. Das Metall wird lokal aufgeschmolzen bzw. verdampft und kondensiert im Wasser direkt zu Nanopartikeln. Die Lösung ist überwiegend ein Nanopartikel-Sol, also ein echtes Kolloid, während der Ionenanteil deutlich geringer bis nicht vorhanden ist.
Daher ist es nicht überraschend, dass hochwertige Hochvolt-Kolloide oft:
- moderate ppm-Werte haben (z. B. 10–30 ppm),
- dafür aber eine klar erkennbare kolloidale Phase,
- einen sauberen Tyndall-Effekt und eine gute Langzeitstabilität.
Wenn dich der physikalische Hintergrund interessiert, findest du dazu einen ausführlichen Artikel hier:
„Hochvolt-Kolloide: Warum mehr als 30 ppm nicht sinnvoll sind“
Und zum Vergleich von Niedervolt- und Hochvoltverfahren:
„Hochvolt vs. Niedervolt – Kolloide vs. Ionen“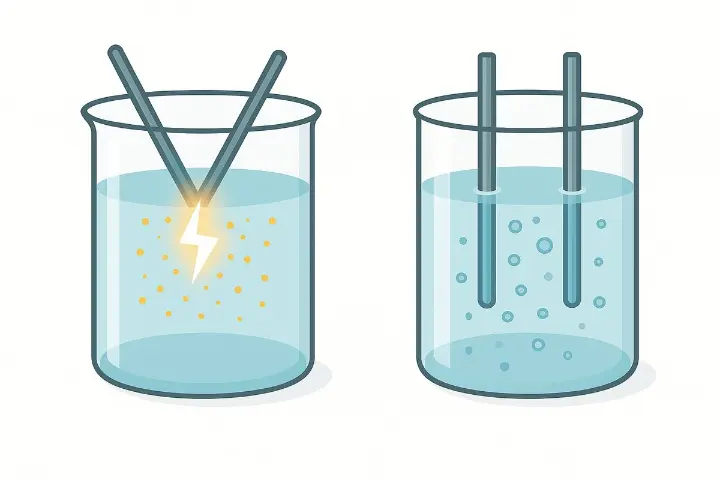
Leitfähigkeit (EC-Wert): ein Bonus-Tool für Technik-Fans
Für besonders interessierte Anwender:innen kann ein einfacher Leitwertmesser (EC-Meter) ein zusätzliches Hilfsmittel sein:
- Eine sehr hohe Leitfähigkeit bei einem „angeblich kolloidalen“ Produkt deutet eher auf viele gelöste Ionen (Salze, Metallionen) hin – typisch für viele einfache Elektrolyseprodukte.
- Ein vergleichsweise niedriger Leitwert bei einer plausiblen, ehrlich angegebenen ppm-Konzentration kann darauf hindeuten, dass ein größerer Anteil des Metalls als neutrale Nanopartikel vorliegt und weniger als freie Ionen.
Aber Vorsicht:
Ein niedriger Leitwert allein beweist noch kein gutes Kolloid. In Kombination mit:
- einem sauberen Tyndall-Effekt,
- stabiler Optik (keine Flocken, kein Bodensatz),
- und transparenten Herstellerangaben zu Metall, ppm und Verfahren
bekommst du aber schon ein sehr rundes Bild.
Checkliste: 5 Punkte, an denen du ein gutes Kolloid erkennen kannst
Zum Abschluss eine kurze, praxisnahe Zusammenfassung:
-
Optik:
Klar, ohne Flocken, keine starken Trübungen oder Schlieren. -
Tyndall-Effekt:
Ein feiner, ruhiger, schmaler und klar begrenzter Lichtstrahl im Laser-Test ist ein deutlicher Hinweis darauf, dass echte Kolloidpartikel mit einer relativ homogenen Partikelgrößenverteilung vorliegen. -
Stabilität:
Bleibt bei normaler Lagerung über längere Zeit stabil, ohne schnellen Bodensatz oder Verfärbung. -
Herstellertransparenz:
Klare Angaben zu Metallreinheit, ppm, Herstellverfahren (Hochvolt/Niedervolt) und keine unrealistischen Versprechen. -
Plausibilität:
Extreme Aussagen wie „500 ppm, glasklar, super billig“ sind aus kolloidchemischer Sicht in der Regel nicht realistisch.
Wie groß sind Kolloide (z. B. Silber, Gold, Silizium)?
„Kolloid“ heißt nur: fein verteilte Teilchen in einem Medium. Klassisch: 1 nm bis 1 µm Partikeldurchmesser. „Nanopartikel“ sind die unteren ~1–100 nm davon. Typische, praxisnahe Bereiche (je nach Herstellmethode/Stabilisator):
- Kolloidales Silber (Ag): meist 5–50 nm, manchmal bis ~100 nm; kleine Fraktionen (<10 nm) kommen vor, aber „einzelne Atome“ sind in Wasser nicht stabil.
- Gold (Au): häufig 5–100 nm. Größe erkennt man sogar an der Farbe (Plasmonik).
- Silizium (Si): kolloidale Si-Nanopartikel oft 5–100 nm.
- Aggregate: In realen Proben können sich Primärpartikel zu Aggregaten/Agglomeraten (zig bis hunderte nm, bis µm) zusammenschließen.
Zum Vergleich:
- Atome: Durchmesser grob 0,1–0,3 nm.
-
Ionen in Wasser (hydratisiert): effektive Durchmesser typ. ~0,3–1 nm (Hydrathülle macht sie „größer“ als nackte Ionen).
Warum ist ein Kolloid etwas anderes als ein Ion oder ein Atom?
| Eigenschaft | Kolloidpartikel (z. B. Ag-NP) | Ion (z. B. Ag⁺, Na⁺, Cl⁻) | Atom (neutrales Ag) |
|---|---|---|---|
| Größe | 1 nm – 1 µm (oft 5–100 nm) | ~0,1 nm „Kern“, aber hydratisiert ~0,3–1 nm | ~0,1–0,3 nm |
| Zustand | Viele Atome zusammen → Feststoff (Kristall/Cluster) mit Oberfläche | Einzelnes geladenes Teilchen in Lösung (mit Hydrathülle) | Einzelnes neutrales Teilchen (in Wasser praktisch nicht stabil; wird zu Ion/Cluster) |
| Stabilität in Wasser | Braucht Stabilisierung (Oberflächenladungen/Dispergiermittel; Zeta-Potenzial), sonst Aggregation | Thermodynamisch stabil gelöst | Einzelatom ist extrem kurzlebig → ionisiert/clusterisiert |
| Transport in Biologie | Zu groß für Kanäle; Aufnahme ggf. via Endozytose; bleibt als Partikel | Durch Ionenkanäle/Transporter; trägt gezielt zur Elektrochemie bei | Keine definierte Rolle in Lösung |
| Optik | Streuung (Tyndall), Metalle: Plasmonresonanz (z. B. Au ~520 nm) | Klar gelöst, keine Plasmonik | – |
| Chemische Reaktivität | Hohe Oberflächenreaktivität, kann Ionen freisetzen (z. B. Ag⁺) | Definierte Ladung/Redox-Zustand | Reagiert zu Ion/Molekül |
Kurz gesagt:
- Ein Kolloid ist ein vielatomiges Teilchen mit Oberfläche, Oberflächenladung/-chemie und kollektivem Verhalten (Streuung, Plasmonik, DLVO-Stabilität).
- Ein Ion ist ein einzelnes, geladenes Atom/Molekül, vollständig gelöst und bewegt sich/wirkt über Konzentrations- und Spannungsgradienten.
-
Ein Atom ist neutral; in Wasser existiert es praktisch nicht frei – es wird zu Ion oder bindet sich in Cluster/Moleküle.
Praktische Messwerte, die Größen bestätigen
- DLS/NTA → hydrodynamischer Durchmesser/Konzentration in Suspension.
- (Kryo-)TEM/SEM → reale Primärpartikelgröße/Shape.
- spICP-MS → Größenspektrum & Partikelzahl (v. a. Metalle).
- UV/Vis → bei Metallen Größe/Monodispersität über Plasmonpeak abschätzen.
Warum wir beim Hochvoltkolloid keine Zusätze brauchen – Niedervolt aber oft schon
Kolloidpartikel brauchen grundsätzlich einen Stabilisierungsmechanismus, sonst würden sie in der Flüssigkeit miteinander verklumpen und ausflocken. Im Hochvolt-Plasmaverfahren entsteht diese Stabilisierung jedoch ganz natürlich: Die frisch gebildeten Metallnanopartikel besitzen eine eigene Oberflächenladung, sind von passenden Gegenionen aus dem Wasser umgeben und tragen oft eine extrem dünne Oxid- oder Hydroxidschicht. Zusammen erzeugt das ein ausreichendes Zeta-Potenzial, um die Partikel ohne zusätzliche Stabilisator-Chemikalien in Schwebe zu halten.
In vielen Niedervolt- oder chemischen Verfahren werden dagegen gezielt „Capping Agents“ wie Citrate, Polymere oder andere organische Moleküle eingesetzt, um Nanopartikel überhaupt erst zu bilden und dauerhaft zu stabilisieren – andernfalls würden sie rasch zu größeren Aggregaten zusammenfallen oder sich als Schlamm am Boden absetzen.
Fazit
Du brauchst kein Labor und kein Chemiestudium, um zwischen einem hochwertigen Kolloid und einer einfachen Metallionenlösung zu unterscheiden. Mit dem Tyndall-Test, einem Blick auf Optik und Stabilität, etwas gesundem Menschenverstand bei Herstellerangaben und optional einem einfachen Leitwertmesser kannst du sehr viel erkennen.
Hochwertige Hochvolt-Kolloide werden technisch aufwendig hergestellt, haben bewusst moderate ppm-Werte und zeigen saubere kolloidale Eigenschaften. Sie sind deshalb weder als Billigprodukt zu haben, noch lassen sie sich durch simple Lebensmittelfarbe nachbauen.
Wenn du auf diese Punkte achtest, bist du als Endkunde deutlich näher an einem physikalisch echten Metallkolloid als an bloß „schön gefärbtem Wasser“.
Häufig gestellte Fragen
Ein Kolloid besteht aus Nanopartikeln (typischerweise etwa 1–1000 nm), die fein im Wasser verteilt sind. Diese Partikel streuen Licht (Tyndall-Effekt) und bleiben bei guter Stabilität lange in Schwebe.
Eine Ionenlösung besteht dagegen nur aus gelösten Ionen (z. B. Silberionen) – dort gibt es keine Partikel in diesem Sinn, der Lichtstrahl bleibt im Medium praktisch unsichtbar.
Der einfachste Test ist der Tyndall-Effekt:
- Kolloid in ein sauberes Glas füllen, Raum leicht abdunkeln.
- Seitlich mit einem Laserpointer (ideal: grüner Laser mit ~532 nm) durchleuchten.
Siehst du im Glas einen feinen, ruhigen, klaren Lichtstrahl, spricht das für eine kolloidale Phase.
Bei einer reinen Ionenlösung bleibt der Lichtweg im Glas weitgehend unsichtbar, ähnlich wie bei Wasser. Wenn der Strahl stark „glitzert“ und viele aufflackernde Punkte zeigt, deutet das auf eine sehr unruhige Partikelgrößenverteilung mit vielen zu großen Aggregaten hin.
Nein. Die Farbe kann zwar Hinweise geben (z. B. Gold oft rötlich/violett, Silber zart gelblich usw.), ist aber kein Beweis für ein echtes Kolloid. Wasser lässt sich mit Farbstoff sehr einfach „goldig“ oder „rosé“ einfärben, ohne dass ein einziges Metallnanopartikel enthalten ist.
Ein Farbstoff-Fake erkennt man daran, dass:
- der Tyndall-Effekt fehlt oder extrem schwach ist,
- keine klaren Angaben zu ppm, Metallreinheit oder Verfahren gemacht werden,
- der Hersteller eher von „Goldwasser“, „Energiewasser, Blutgold, Alchemistisches Kolloid“ o. Ä. spricht als von echten Kolloiden.
Für klassisches kolloidales Gold liegt der praxisnahe „Sweet Spot“ ungefähr im Bereich von ca. 5–30 nm, grob erweitert bis etwa 50 nm.
- In diesem Bereich zeigen sich die typischen ganz leichte Rosa-/Rot-/Rubin-Färbungen,
- ein klarer Tyndall-Effekt
- und eine gute kolloidchemische Stabilität.
Deutlich größere Partikel (50–100 nm und mehr) führen schneller zu Trübung, Aggregation und Bodensatz und sind für feine Hochvolt-Goldkolloide nicht das Ziel.
Beim Niedervoltverfahren (klassische Elektrolyse) entstehen hauptsächlich Metallionen im Wasser. Ein kleiner Teil kann sich zwar zu Nanopartikeln zusammenschließen, aber der Hauptanteil bleibt eine ionische Metalllösung mit kolloidalem Anteil.
Beim Hochvolt-Plasmaverfahren entsteht ein Lichtbogen mit sehr hohen Temperaturen. Das Metall wird lokal aufgeschmolzen/verdampft und kondensiert im Wasser direkt zu metallischen Nanopartikeln. Das Ergebnis ist überwiegend ein Nanopartikel-Sol, also ein physikalisch „echtes Kolloid“ mit deutlich geringerem Ionenanteil.
Ja, als Zusatz-Info:
- Ein sehr hoher Leitwert bei einem angeblich „kolloidalen“ Produkt deutet eher auf viele gelöste Ionen (Salze, Metallionen) hin – typisch für einfache Elektrolyselösungen.
- Ein moderater Leitwert bei einer plausiblen ppm-Angabe passt eher zu einem höheren Anteil neutraler Nanopartikel, also eines echten Kolloids.
Wichtig: Der EC-Wert ist nur ein Baustein. Zusammen mit Tyndall-Effekt, Optik, Stabilität und Herstellertransparenz ergibt sich das Gesamtbild.
Ja. Als Faustregeln:
- Optik: klar, keine Flocken, keine starken Trübungen.
- Laser-Test: ruhiger, schmaler Tyndall-Strahl statt wildes Gefunkel oder gar kein Strahl.
- Stabilität: bleibt über längere Zeit stabil, ohne schnellen Bodensatz.
- Transparenz: ehrliche Angaben zu Metall, ppm, Verfahren (Hochvolt/Niedervolt).
- Plausibilität: keine extremen Versprechen wie „100 oder gar 1000 ppm, glasklar, spottbillig“.

Woran erkenne ich ein hochwertiges Kolloid?